|
ВСЁ о строении атома |
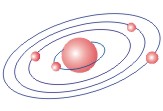
ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА |
 |
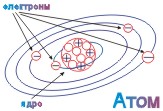 |
АТОМНОЕ ЯДРО |
|
|
|
1,675 * 10-24 г. | |||||||||||||||||||
|
||||||||||||||||||||
|
| |||||||||||||||||||
|
||||||||||||||||||||
|
|
ИЗОТОПЫ |
Изотоп |
Обозначение |
В природной смеси | ||||||||||||||||
углерод - 12 |
|
98, 892 % | ||||||||||||||||
углерод - 13 |
|
1, 108 % |
ЭЛЕКТРОН |
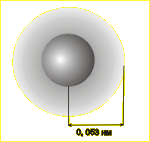
ДВИЖЕНИЕ ЭЛЕКТРОНА В АТОМЕ |
" Быть может, эти электроны -
|
Движение электрона в атоме подчиняется законам квантовой механики. Они не допускают интерпритации.
С помощью приборов мы можем наблюдать не сам электрон, а результат его взаимодействия с веществом. |
|
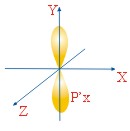
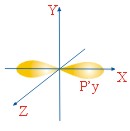
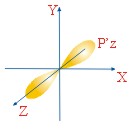
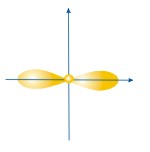
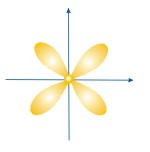
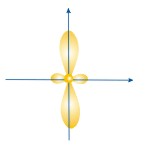
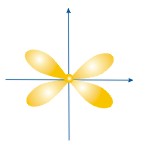
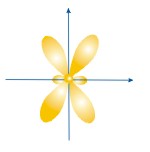
Пространство, в котором движется электрон, называют орбиталью
Вероятность нахождения электрона в орбитали характеризует электронная плотность. |
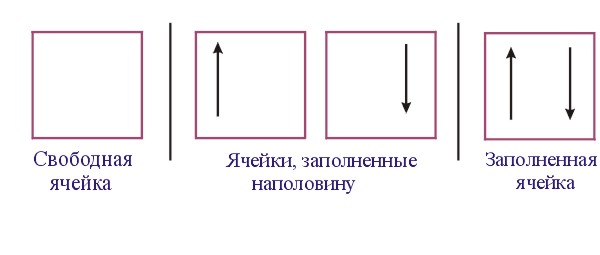
ЭЛЕКТРОННАЯ ОБОЛОЧКА АТОМА |
|
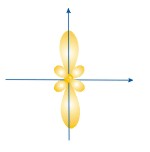
ФОРМЫ ЭЛЕКТРОННЫХ ОРБИТАЛЕЙ |
|
|
 |
 |
 |
|
|
|

|

|

|
|
|
|

|

|

|